Plusieurs sujets de thèse sont proposés cette année au C3M pour débuter à l’automne 2023.
Ces propositions de thèse sont soumises à l’obtention d’un contrat de financement doctoral.
Pour postuler aux contrats doctoraux de l’Ecole doctorale Sciences du Vivant de nice, veuillez contacter le potentiel directeur de thèse avant le 5 juin 2023.
Equipe Dysregulations de l’Hématopoïèse : Approches Fondamentales et Translationnelles
Recherche de nouvelles stratégies thérapeutiques pour traiter la rechute de la leucémie aiguë lymphoblastique T chez l’enfant
La leucémie aiguë lymphoblastique à cellules T (LAL-T) pédiatrique, qui provient de la transformation des lymphocytes T, est une forme de cancer très agressive. Malheureusement, des rechutes surviennent encore dans 10 à 15 % des cas avec un très mauvais pronostic puisque près de 70 % des enfants en rechute décèdent en raison du manque d’options thérapeutiques efficaces à ce stade de la leucémie.
Dans ce projet de doctorat, nous visons à mieux comprendre la LAL-T pédiatrique en disséquant les mécanismes moléculaires et biologiques responsables de la résistance à la chimiothérapie. En identifiant et en caractérisant les gènes impliqués dans la résistance, nous souhaitons découvrir de nouvelles cibles thérapeutiques, de nouveaux médicaments actifs ainsi que des biomarqueurs permettant de prédire la rechute.
Pour atteindre ces objectifs, nous avons utilisé la technologie de séquençage de l’ARN sur cellule unique pour comparer les profils d’expression génique d’échantillons de LAL-T pédiatrique obtenus au moment du diagnostic ou après une rechute. Cette investigation au niveau des cellules leucémiques individuelles met en évidence l’hétérogénéité des cellules leucémiques et leur plasticité, deux propriétés essentielles qui favorisent leur adaptation et leur résistance aux médicaments chimiothérapeutiques. Nos analyses bioinformatiques ont identifié plusieurs gènes candidats et voies de signalisation potentiellement responsables de la résistance aux traitements, que nous prévoyons de valider au cours de cette thèse par des essais fonctionnels dans différents modèles cellulaires et murins.
De plus, nous avons développé un modèle de souris KO pour la LAL-T généré par la délétion spécifique de la cellule T du gène suppresseur de tumeur PTEN (tPTEN-/-). En outre, nous avons généré des souris doublement KO pour étudier le rôle du facteur de transcription NF-kB dans l’orchestration d’une réponse immunitaire anti-leucémique. La modulation (ON-OFF) de l’activation de NF-kB in vivo retarde ou accélère le développement leucémique. Ces différents modèles de souris seront utilisés pour identifier et caractériser par cytométrie de flux et single cell RNAseq, les différentes populations immunitaires qui participent à la réponse anti-leucémique.
Méthodes :
Le candidat bénéficiera de plusieurs modèles biologiques et approches expérimentales, incluant des expériences in vitro sur des lignées cellulaires immortalisées humaines et des expériences ex-vivo sur des xénogreffes dérivées de patients T-ALL (PDX), établies par l’équipe dans des souris NSG immunodéficientes. Les souris tPTEN-/- seront utilisées pour étudier les mécanismes moléculaires du développement de la leucémie et en tests pré-cliniques in vivo de nouveaux médicaments anti-leucémiques.
La cytométrie en flux sera systématiquement utilisée pour les analyses fonctionnelles (prolifération/survie/mort). Divers essais permettront de contrôler la prolifération cellulaire, l’activité mitochondriale (WST1), le métabolisme cellulaire (glycolyse/Oxphos par SeaHorse). Les voies de signalisation seront étudiées par des expériences de Simple-Western. Des inhibiteurs pharmacologiques, des siRNA, CrispR-Cas9 seront utilisés pour interférer avec les gènes/voies candidats et valider leur implication fonctionnelle. Des cellules PDX provenant de différents patients résistants et maintenues dans des conditions de co-culture sur des cellules nourricières mésenchymateuses seront utilisées pour cribler des bibliothèques de médicaments afin d’identifier les dépendances leucémiques qui sont des cibles potentielles.
Candidat(e) :
Nous recherchons un(e) étudiant(e) de Master motivé(e) et enthousiaste, ayant de l’expérience en biologie cellulaire, biochimie, techniques de biologie moléculaire, appliquées à des projets sur le cancer. De l’expérience en cytométrie de flux et en manipulation de souris serait un plus. Le candidat idéal doit être capable de travailler au sein d’une équipe et devra démontrer un fort désir de développer son autonomie.
Globalement, ce projet de doctorat a le potentiel d’identifier de nouvelles stratégies thérapeutiques pour traiter les LAL-T pédiatriques récidivantes, ce qui pourrait avoir un impact significatif sur l’amélioration du taux de survie des enfants atteints de cette maladie.
Bibliographie :
Can one target T-cell ALL
Adolfo Ferrando
Best Practice & Research Clinical Haematology 31 (2018) 361–366
https://doi.org/10.1016/j.beha.2018.10.001
Contact :
Dr Jean-François Peyron, directeur de recherche Inserm
Jean-Francois.Peyron@unice.fr
Equipe Dysregulations de l’Hématopoïèse : Approches Fondamentales et Translationnelles
Etude du rôle du complexe CIA dans l’hématopoiëse normale et pathologique.
Les clusters fer-soufre (Fe-S) sont des structures chimiques essentielles à l’activité de nombreux enzymes, au métabolisme énergétique et à la régulation de l’expression génique à la fois dans les organismes procaryotes et eukaryotes. Environ 1% de l’ensemble des protéines contiennent des clusters Fe-S. Les deux complexes permettant l’inclusion des cluster Fe-S dans les protéines sont la machinerie mitochondriale ISC qui intègre des clusters Fe-S dans les protéines mitochondriales et le complexe cytosolique CIA (Cytoplasmic Iron-sulfur Assembly) chargé de la maturation des protéines Fe-S cytoplasmiques et nucléaires.
Plusieurs maladies humaines liées à des anomalies de la biogénèse Fe-S ont été décrites, impliquant pour la plupart la machinerie ISC. Il s’agit surtout de mutations hypomorphes entraînant des affections neuro-musculaires comme l’ataxie de Friedreich (FXN) ou des myopathies héréditaires (ISCU, FDX1L, NUBPL,…). Des cas d’anémies sidéroblastiques héréditaires témoignant d’un défaut d’incorporation normale du fer dans la lignée érythroide, sont également rapportés à des mutations de protéines Fe-S, comme GLRX5 et ABCB7. De nombreuses protéines clefs comme es nucleases RTEL1 et RAD3/XPD, les déméthylases, ROS1 par exemple, ainsi que des ribonucleotide réductases, dépendent de la biogenese Fe–S cytosolique pour remplir leur fonctions.
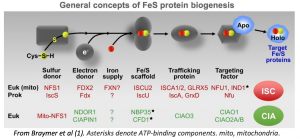
Le service d’hématologie pédiatrique du CHU de Nice prend en charge une jeune patiente porteuse d’une dysérythropoièse décompensée à l’âge de 18 ans, accompagnée d’un déficit immunitaire modéré T et B et d’une surcharge martiale. Le myelogramme montre des sidéroblastes de type II évoquant une surcharge martiale cytosolique. Nous avons dénommé cette anémie isolée d’apparition tardive : syndrome ISAC (Isolated Sideroblastic Anemia of Constitutional origin). Une étude d’exome global a mis en évidence chez la patiente deux mutations hétérozygotes affectant une protéine du complexe CIA, non encore décrité à l’origine de ce type d’affection. Cette substitution est classée comme délétère par SIFT et Polyphen et sa fréquence est estimée inférieure à 0,001%. Les deux parents sains sont porteurs chacun d’une des deux mutations, elle a un frère et une sœur sains, porteur chacun d’une des deux mutations parentales. L’anémie pourrait s’expliquer par un défaut d’activité Aconitase/IRP1 que nous avons mis en évidence chez la patiente. L’aconitase/IRP1 est une protéine Fe-S qui joue un rôle central dans la régulation de l’érythropoièse. Nous avons également montré une hypersensibilité des cellules au stress oxydatif et leur capacité à pousser uniquement en milieu hypoxique.
Notre projet comporte donc plusieurs objectifs :
- étudier les mécanismes expliquant l’anémie sidéroblastique présentée par la patiente
- rechercher des thérapeutiques permettant de suppléer l’insuffisance fonctionnelle du CIA
- étudier le rôle du CIA dans le maintien au long terme de l’érythropoiëse et de l’homeostasie du fer au niveau cellulaire
- étudier le rôle du CIA dans la croissance de cellules leucémiques et son ciblage potentiel à visée thérapeutique : en effet, cette protéine est surexprimée dans plusieurs lignées de leucémies aiguës.
Méthodes :
Pour répondre aux objectifs de la recherche, nous prévoyons d’utiliser des modèles cellulaires, des études génomiques, et un modèle animal. Le rôle du CIA dans le blocage de la différentiation érythropoiétique et de la pousse cellulaire sera étudié en transfectant les cellules de la patiente avec un vecteur d’expression lentiviral utilisant des enveloppes optimisées de virus de babouin. L’effet de l’inhibition de CIA sur l’érythropoièse sera étudié dans le modèle d’érythroleucémie K562, en utilisant des siRNA inductibles.
L’impact d’un blocage du CIA sur les protéines impliquées dans le cycle cellulaire et la réplication de l’ADN comme RTEL1 et XPD sera étudié en western-blot. Une étude single-cell sur un échantillon de moelle osseuse permettra d’analyser finement quelle étape de la différentiation érythroide est l’objet d’un blocage.
L’impact du stress oxydatif et les mécanismes de mort cellulaire, notamment la ferroptose seront étudiés en comparant les cellules cultivées à 21% et à 1% d’O2. L’étude du cycle cellulaire du fer mitochondrial et cytoplasmique sera entreprise. Ces informations peuvent déboucher sur une meilleure adaptation des traitements chélateurs visant à diminuer la surcharge martiale organique de la patiente, particulièrement au niveau cardiaque.
La génération d’un modèle animal mimant la pathologie est en cours via la technologie Crisp-Cas9 (CIPHE, Marseille). Les souris obtenues seront alors élevées dans différentes conditions de supplémentation martiale et l’érythropoièse sera étudiée. Ce modèle permettra alors de tester différents chélateurs du fer (deferiprone, deferasirox, deferroxamine) sur la surchage martiale hépatique et cardiaque et de tester par transfert de cellules souches l’effet modificateur d’une greffe de moelle saine sur ces atteintes. Des essais de thérapie génique chez l’animal pourront également être poursuivis dans un deuxième temps par CrispR.
Le potentiel du blocage de CIA dans des cellules leucémiques (LAM et LAL) sera étudié via des miRNA, et en association avec des composés antileucémiques connus.
Résultats :
Les résultats obtenus conduiront à la description d’une nouvelle maladie dont le mécanisme est original et à des publications dans des revues de niveau A.
Candidat(e) :
Des connaissances solides en culture cellulaire, biologie moléculaire sont nécessaires. L’utilisation de modèles souris est prévue, mais une connaissance préalable de la souris n’est pas indispensable.
Financement(s) envisagé(s) :
Ecole doctorale
Fondation maladies rares
Bourse MARIH
Bibliographie :
Braymer JJ, Freibert SA, Rakwalska-Bange M, Lill R. Mechanistic concepts of iron-sulfur protein biogenesis in Biology. Biochim Biophys Acta Mol Cell Res. 2021 Jan;1868(1):118863. doi: 10.1016/j.bbamcr.2020.118863.
Autres informations : co-tutelle, codirection
Le projet est dirigé par Pierre Rohrlich au sein de l’équipe DYSHEMA dirigée par Jean-François Peyron au sein du Centre Méditerranéen de Médecine Moléculaire. Le coordinateur a plus de 30 ans d’expérience en hématologie de l’enfant et du jeune adulte, il est responsable du Centre de Compétence des Maladies Constitutionnelles du Globule Rouge et de l’érythropoiëse (MCGRE) du CHU de Nice, et travaille en collaboration avec les centres experts (Marseille, Mondor, Bichat). Son experience clinique est complétée par une expertise scientifique acquise à l’Institut Pasteur ou il a notamment étudié HFE, molécule impliquée dans le métabolisme martial.
Le consortium réunit 3 équipes de recherche, 2 au C3M : équipe DYSHEMA dirigée par Jean-François Peyron et Pierre Rohrlich, et l’équipe MCARE d’Els Verhoeyen, et une équipe parisienne à Bichat : Pr Katell Peoch et Pr Kannengiesser (Centre de Recherche sur l’Inflammation UMRs INSERM 1149)
Contact :
Dr Jean-François Peyron, directeur de recherche Inserm
Jean-Francois.Peyron@unice.fr
Equipe Microenvironnement, Signalisation et Cancer
Rôle des canaux calciques dans la reprogrammation biomécanique et la résistance thérapeutique des mélanomes
Le mélanome est un cancer de la peau particulièrement difficile à soigner aux stades avancés de la maladie du fait de son agressivité, sa plasticité et sa résistance thérapeutique. La prise en charge du mélanome métastatique a connu une révolution avec l’arrivée des thérapies ciblées et les immunothérapies. Toutefois ces thérapies ne bénéficient qu’à certains patients et leur utilisation est limitée dans le temps du fait de l’émergence rapide de résistances. Notre équipe s’intéresse aux mécanismes qui rendent compte de l’échappement des mélanomes à l’action des thérapies anticancéreuses dans le but d’identifier de nouvelles cibles thérapeutiques permettant d’améliorer l’efficacité des traitements existants et de prolonger leurs effets. Nos résultats récents établissent une relation étroite entre la plasticité des cellules tumorales, leur sensibilité aux signaux mécaniques qui émanent du microenvironnement et la résistance thérapeutique. Nous avons montré que l’acquisition d’un phénotype dédifférencié s’accompagne d’une reprogrammation biomécanique des mélanomes leur conférant une sensibilité accrue aux changements de rigidité de la matrice extracellulaire. Cette reprogrammation biomécanique est associée à des changements d’expression de plusieurs canaux calciques. Ces canaux étant décrits comme des senseurs des propriétés physico-chimiques du microenvironnement tumoral, notre hypothèse est qu’ils pourraient contribuer à la mécanosensibilité du mélanome et influencer sa prolifération, sa motilité et sa réponse thérapeutique. Pour tester ces hypothèses, le/la candidat(e) retenu(e) en thèse combinera des approches de biologie moléculaire et cellulaire ainsi que biochimiques et biophysiques à partir de modèles précliniques in vitro et in vivo pertinents.
Le projet de thèse s’articulera autour de 3 axes :
- Influence des changements de rigidité de la matrice extracellulaire et des acteurs de la mécanotransduction sur l’expression/activation des canaux calciques et caractérisation des mécanismes impliqués.
- Rôle des canaux calciques dans la prolifération, l’invasion et la résistance des mélanomes in vitro
- Impact du ciblage pharmacologique des canaux calciques sur la progression et la résistance thérapeutique des mélanomes in vivo.
Ces travaux amélioreront nos connaissances sur le dialogue existant entre les cellules tumorales et le réseau matriciel et permettront de mieux appréhender les processus impliqués dans la résistance thérapeutique. De plus, ils devraient conduire à l’identification de nouvelles cibles thérapeutiques et ouvriront des pistes innovantes dans le but d’améliorer la prise en charge du mélanome métastatique réfractaire.
Mots Clés : Mélanome, Microenvironnement, Mécanotransduction, Canaux calciques, Signalisation moléculaire.
Candidat(e) :
Le/la candidat(e), titulaire d’un Master 2 ou équivalent, devra posséder de solides connaissances en biologie moléculaire et cellulaire. Il/elle devra également présenter un intérêt particulier pour la mécano biologie appliquée à la cancérologie.
Bibliographie :
Shoji KF,…, Tartare-Deckert S, Penna A. The mechanosensitive TRPV2 calcium channel promotes human melanoma invasiveness and metastatic potential. EMBO Rep, e55069, 2023.
Diazzi S,…, Girard C.A,…, Mari B*, Tartare-Deckert S*. Blockade of pro-fibrotic response mediated by the miR-143/-145 cluster prevents targeted therapy-induced phenotypic plasticity and resistance in melanoma. EMBO Mol Med, 4, e15295, 2022.
Berestjuk I,…, Girard CA, Deckert M*, Tartare-Deckert S*. « Targeting Discoidin Domain Receptors DDR1 and DDR2 overcomes matrix-mediated tumor cell adaptation and tolerance to BRAF-targeted therapy in melanoma. EMBO Mol Med, 14, e11814,2022.
Girard CA*,…, Deckert M*, Tartare-Deckert S*. A feed-forward mechanosignaling loop confers resistance to therapies targeting the MAPK pathway in BRAF-mutant melanoma. Cancer Res, 80, 1927-1941, 2020.
Leverrier-Penna S,…, Penna A. Insights and perspectives on calcium channel functions in the cockpit of cancerous space invaders. Cell Calcium, 90:102251, 2020.
Lecacheur M, Girard CA,…, Tartare-Deckert S. Echappement thérapeutique du mélanome : la piste biomécanique. Med Sci(Paris), 36, 961-965, 2020.
Contacts :
Directeur de thèse :
Dr GIRARD Christophe, CRCN CNRS
christophe.girard@univ-cotedazur.fr
+33 (0)4 89 15 38 52
Co-directeur de thèse :
Dr PENNA Aubin, CRCN CNRS
aubin.penna@univ-poitiers.fr
+33 (0)5 49 45 39 96








